
Maria Salomea Sklodowska nació en Varsovia en 1867, cuando Polonia se encontraba bajo dominio ruso, y las mujeres no tenían acceso a los estudios superiores. Tuvo que trabajar para pagar los estudios de medicina de su hermana en París y en 1891 se trasladó a esta ciudad para estudiar matemáticas, física y química. En 1895 se casó con su colega Pierre Curie. Tuvo una hija en 1897 y siguió investigando con Pierre en un almacén adaptado como laboratorio.
A la muerte de su marido, le sucedió en su cátedra en la Sorbona: fue la primera mujer en ocupar este puesto. También fue la primera mujer galardonada con un premio Nobel y la primera persona de la historia en recibir un segundo Nobel. Durante la Primera Guerra Mundial colaboró en la construcción de centros de radiología. Murió en 1934 de una anemia probablemente causada por su prolongada exposición a la radiactividad.
- Obras principales
- 1898 Rayons émis par les composés de l’uranium et du thorium.
- 1935 Radioactivité.
La radiactividad
- Disciplina: Física
- Antes:
- 1895 Wilhelm Röntgen investiga las propiedades de los rayos X.
- 1896 Henri Becquerel descubre que las sales de uranio emiten una radiación penetrante.
- 1897 J. J. Thomson descubre el electrón mientras estudia las propiedades de los rayos catódicos.
- Después:
- 1904 Thomson propone el modelo de átomo conocido como «pudín de pasas».
- 1911 Ernest Rutherford y Ernest Marsden proponen el modelo de átomo llamado «nuclear», o «planetario».
- 1932 El físico británico James Chadwick descubre el neutrón.
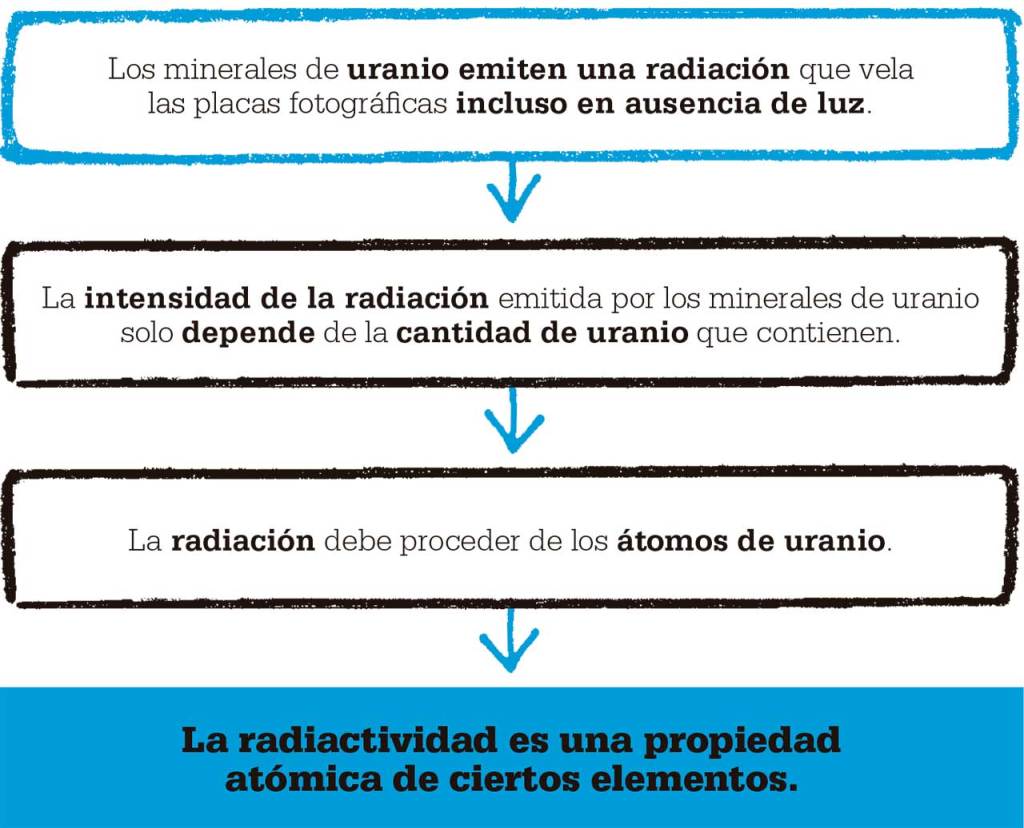
Al igual que otros importantes hallazgos científicos, el de la radiactividad fue fruto del azar. En 1896, el físico francés Henri Becquerel estaba investigando la fosforescencia, que aparece cuando la luz incide sobre una sustancia que entonces empieza a emitir luz de distinto color. Becquerel quería saber si los minerales fosforescentes también emitían rayos X, descubiertos por Wilhelm Röntgen el año anterior. Para determinarlo, colocó uno de estos minerales sobre una placa fotográfica envuelta en un grueso papel negro y lo expuso a la luz solar: la placa se veló, por lo que parecía que el mineral había emitido rayos X. Becquerel también demostró que ciertos metales bloqueaban los «rayos» que velaban la placa fotográfica. El día siguiente estuvo nublado, por lo que no pudo repetir el experimento, y dejó el mineral sobre una placa fotográfica en un cajón, pero la placa también se oscureció, incluso en ausencia de luz solar. Dedujo que el mineral debía tener una fuente de energía interna, que resultó ser el resultado de la desintegración de los átomos de uranio de dicho mineral. Acababa de detectar la radiactividad.
Rayos producidos por átomos
Tras el descubrimiento de Becquerel, la estudiante de doctorado polaca Marie Curie decidió dedicar su tesis a estos nuevos «rayos». Utilizando un electrómetro (aparato para medir corrientes eléctricas), Marie descubrió que el aire que rodeaba una muestra de mineral que contenía uranio conducía electricidad. El nivel de actividad eléctrica dependía exclusivamente de la cantidad de uranio presente, no de la masa total del mineral (que contenía otros elementos además de uranio). Esto la indujo a creer que la radiactividad procedía de los átomos de uranio, no de reacciones entre el uranio y el resto de elementos.
Marie descubrió pronto que algunos minerales que contenían uranio eran más radiactivos que el propio uranio y se preguntó si contendrían otra sustancia más activa aún que este. En 1898 había identificado el torio como otro elemento radiactivo. Aunque se apresuró a presentar sus conclusiones en un artículo para la Academia de las Ciencias francesa, el descubrimiento de las propiedades radiactivas del torio ya se había publicado.
Una pareja de científicos

Marie y su marido, Pierre Curie, investigaron juntos para descubrir el resto de elementos radiactivos responsables de la elevada actividad de la pechblenda y la calcolita. A finales de 1898 anunciaron el descubrimiento del polonio (así llamado por Polonia, el país natal de Marie) y el radio. Intentaron obtener muestras puras de estos nuevos elementos, pero hasta 1902 solo lograron extraer 0,1 g de cloruro de radio a partir de una tonelada de pechblenda.
En ese periodo, los Curie publicaron decenas de artículos científicos, en uno de los cuales señalaron que el radio podría contribuir a eliminar tumores. Aunque no patentaron sus descubrimientos, en 1903 se les concedió a ambos el premio Nobel de física, compartido con Becquerel. Marie prosiguió sus investigaciones tras el fallecimiento de su esposo en 1906 y consiguió aislar una muestra de radio puro en 1910. En 1911 se le otorgó el premio Nobel de química, lo que la convirtió en la primera persona en recibir dos de estos galardones.
Un nuevo modelo del átomo
Los descubrimientos de los Curie prepararon el terreno para que dos físicos nacidos en Nueva Zelanda, Ernest Rutherford y Ernest Marsden, formularan un nuevo modelo del átomo en 1911. Sin embargo, hubo que esperar hasta 1932 para que el físico inglés James Chadwick descubriera los neutrones, y el proceso de la radiactividad pudiera explicarse completamente.
Los neutrones y los protones (con carga positiva) son partículas subatómicas que constituyen el núcleo del átomo, en torno al cual orbitan sin cesar electrones (con carga negativa). Los protones y los neutrones suponen la mayor parte de la masa del átomo. Los átomos de un elemento concreto siempre cuentan con el mismo número de protones, pero el de neutrones puede variar. Los átomos de un mismo elemento con distinto número de neutrones se llaman isótopos de dicho elemento. Por ejemplo, el núcleo de un átomo de uranio siempre tendrá 92 protones, pero puede tener entre 140 y 146 neutrones. Los isótopos se denominan según el número total de protones y de neutrones: así, el isótopo más abundante del uranio, con 146 neutrones, recibe el nombre de uranio-238 (92 + 146).
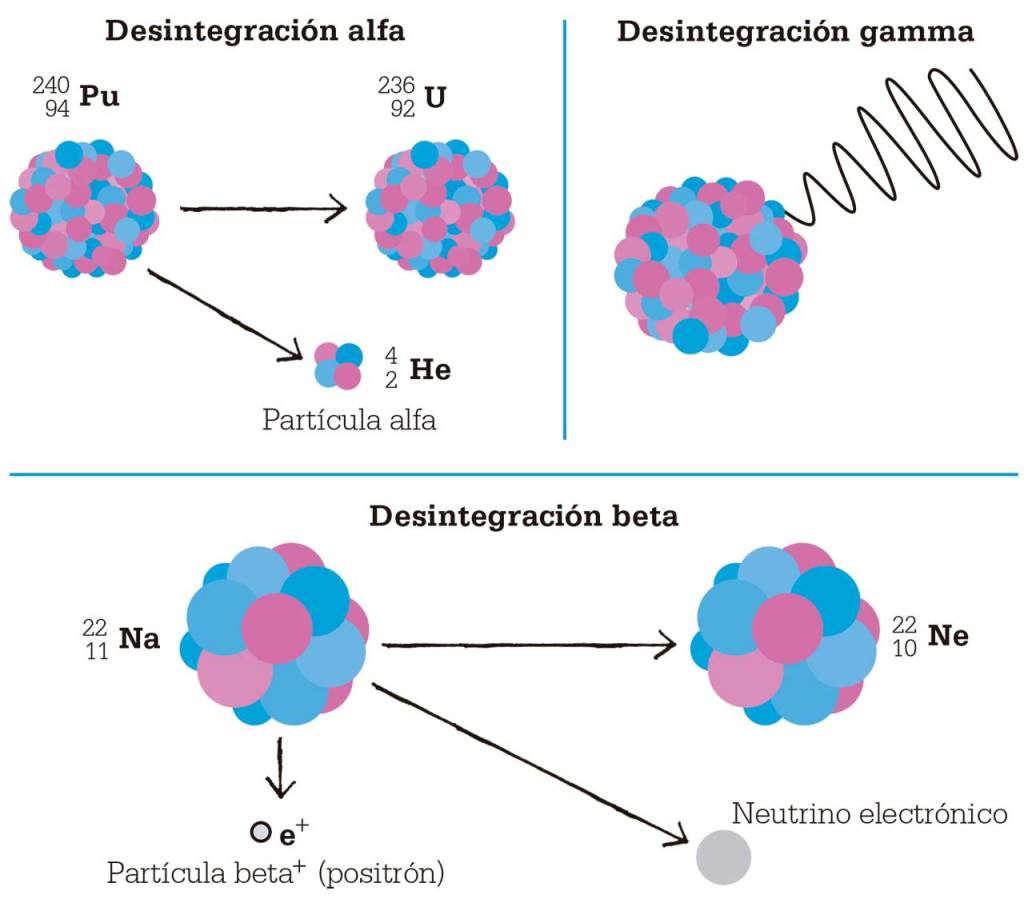
Al igual que el uranio, muchos elementos pesados poseen núcleos inestables, lo que provoca una desintegración radiactiva espontánea. Rutherford llamó rayos alfa, beta y gamma a las emisiones de los elementos radiactivos. El núcleo se estabiliza cuando emite una partícula alfa, una partícula beta o rayos gamma. Una partícula alfa consiste en dos protones y dos neutrones. Los partículas beta pueden ser, o bien electrones, o bien sus opuestos, los positrones, que el núcleo emite cuando un protón se transforma en neutrón, o viceversa. Tanto la desintegración alfa como la beta modifican el número de protones del núcleo del átomo, que se transforma en un átomo de un elemento distinto. Los rayos gamma son una forma de radiación electromagnética de onda corta y alta energía, y no modifican la naturaleza del elemento.
La desintegración radiactiva es un fenómeno distinto de la fisión, que tiene lugar en los reactores nucleares, y de la fusión, que da al Sol su energía. En la fisión, los núcleos inestables, como los del uranio-235, son bombardeados con neutrones y se rompen para formar otros átomos mucho más pequeños en un proceso que libera energía. En la fusión, dos núcleos pequeños se unen para formar otro más grande. Este proceso también libera energía, pero las altísimas presiones y temperaturas necesarias para iniciarlo explican por qué los científicos solo han logrado la fusión en forma de armas nucleares. Hasta ahora, los intentos de usar la fusión nuclear para generar electricidad consumen más energía de la que producen.
La vida media
A medida que el material nuclear se desintegra, los átomos del elemento radiactivo se transforman en otros elementos, por lo que el número de átomos inestables disminuye con el tiempo. Cuantos menos átomos inestables haya, menos radiactividad se producirá. La reducción de la actividad de un isótopo radiactivo se mide por su vida media, o periodo de semidesintegración, el tiempo necesario para que el número de átomos inestables de una muestra haya descendido a la mitad. Por ejemplo, el isótopo tecnecio-99m, que se utiliza mucho en medicina, tiene una vida media de seis horas. Esto significa que a las seis horas de haber inyectado una dosis, la actividad habrá descendido a la mitad del nivel original; 12 horas después, habrá descendido a una cuarta parte, etc. En cambio, la vida media del uranio-235 es superior a los 700 millones de años.
La datación radiométrica

El conocimiento de la vida media de ciertos elementos radiactivos permite datar minerales y otros materiales. El carbono es uno de los mejores. El isótopo más abundante del carbono es el carbono-12, con seis protones y seis neutrones en cada átomo. El carbono-12 tiene un núcleo estable y supone el 99% de todo el carbono de la Tierra. El carbono-14, cuyos átomos tienen dos neutrones más, es mucho más raro. Se trata de un isótopo inestable, con una vida media de 5.730 años, que se produce en las capas superiores de la atmósfera continuamente, cuando los átomos de nitrógeno son bombardeados por rayos cósmicos. De este modo, la proporción de carbono-12 y carbono-14 en la atmósfera se mantiene relativamente constante. Como durante la fotosíntesis las plantas absorben dióxido de carbono de la atmósfera y nuestra alimentación se basa en plantas (o en animales que comen plantas), la proporción también permanece relativamente constante en las plantas y los animales vivos, pese a la continua desintegración del carbono-14. Cuando un organismo muere, deja de absorber carbono-14, pero el que ya contiene sigue desintegrándose. Así, midiendo la proporción entre el carbono-12 y el carbono-14 presentes en el cuerpo, los científicos pueden calcular cuánto tiempo hace que murió el organismo en cuestión.
Este método radiométrico se usa para datar madera, carbón, huesos y conchas. Las proporciones de los isótopos de carbono pueden variar pero las fechas pueden confirmarse o corregirse mediante otros métodos de datación, como los anillos de crecimiento de los árboles.
Uso terapéutico de la radiactividad
En el curso de sus investigaciones, Marie Curie se dio cuenta de la utilidad terapéutica de la radiactividad. Durante la Primera Guerra Mundial usó una pequeña cantidad de radio para producir radón, un gas radiactivo que mataba tejidos enfermos. Considerado un remedio casi milagroso, se utilizó en productos de belleza como tratamiento reafirmante de la piel. Más tarde se descubrió lo importante que era utilizar materiales con una vida media corta.
Los radioisótopos también son utilizados habitualmente en las técnicas de diagnóstico por la imagen y en el tratamiento del cáncer. Los rayos gamma sirven para esterilizar instrumental quirúrgico e incluso alimentos, para retrasar la fecha de caducidad. También permiten obtener imágenes del interior de objetos metálicos, para detectar grietas o inspeccionar el contenido de contenedores de carga.
El texto y las imágenes de esta entrada son un fragmento de: “El libro de la ciencia”
- Más artículos de El libro de la Ciencia:
- El principio de la selección natural. Charles Darwin
- Robert FitzRoy. La predicción del tiempo

