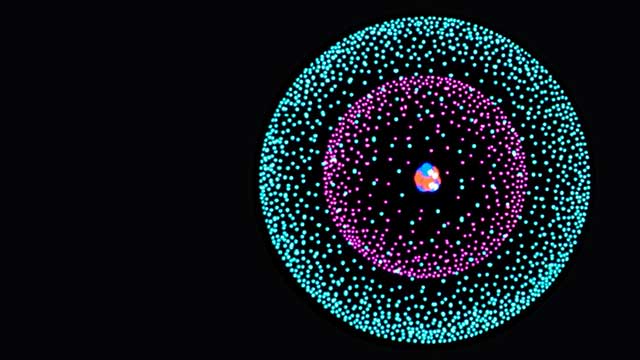
Una realidad en la que los electrones pueden existir en muchos lugares al mismo tiempo, en la que pueden tener propiedades tanto de partículas como de ondas y en la que su comportamiento está guiado por la probabilidad, resulta muy poco familiar. Estas extrañas características de la escala atómica se pueden predecir desde el área más sólida y más rigurosa de la ciencia moderna: la mecánica cuántica.
¿Qué es la mecánica?
La mecánica es una rama de la física con la que podemos predecir el comportamiento de los objetos sujetos a fuerzas. Es posible, por ejemplo, determinar cuánto tardará en caer una bola lanzada al aire y dónde caerá ‒siempre que conozcamos su masa, la velocidad y la dirección en la que ha sido lanzada y cualquier fuerza que actúe sobre ella, como la gravedad y la resistencia del aire‒. El pionero de la mecánica fue Isaac Newton, quien, en 1687, creó sus famosas tres leyes del movimiento. Expresadas matemáticamente, estas leyes eran todo lo que se necesitaba para lograr que una persona aterrizase sobre la Luna. Los arquitectos e ingenieros también las utilizan rutinariamente, por ejemplo, cuando diseñan puentes o motores.
Leyes de Newton

Newton estableció sus tres leyes del movimiento en Principios matemáticos de filosofía natural (Philosophiæ Naturalis Principia Mathematica, 1687). Resumida en forma no matemática:
- La primera ley establece que el movimiento de un objeto no puede cambiar si no actúa alguna fuerza sobre él.
- La segunda ley establece que un objeto acelerará si actúa sobre él una fuerza, cambiando su velocidad y/o la dirección del movimiento en una cantidad que depende de la magnitud de la fuerza aplicada y de la masa del objeto.
- La tercera ley establece que siempre que un objeto ejerza una fuerza sobre otro, el segundo objeto ejercerá una fuerza igual, pero de sentido contrario, sobre el primero.
En el mismo libro, Newton utilizó sus leyes del movimiento y su forma de entender la gravedad para elaborar un experimento mental en el que un cañón disparaba horizontalmente desde la cima de una montaña (véase abajo). La bala de cañón caería al suelo –cuanto más rápidamente saliera disparada del cañón, más lejos viajaría antes de caer sobre el suelo–. Si se disparaba con la suficiente fuerza, su caída coincidiría con la curvatura de la Tierra y la orbitaría.
Teorías de Maxwell y Einstein
A pesar del éxito y de la aplicación generalizada de las leyes de Newton, los físicos de la segunda mitad del siglo XIX pensaron que se trataba de una descripción errónea de la realidad. Los desafíos a la cómoda visión «mecanicista» que Newton tenía del universo condujeron al nacimiento de la física moderna durante los primeros años del siglo XX. El primer desafío fue la elegante teoría del electromagnetismo creada por James Clerk Maxwell ‒la teoría que hizo patente que la luz es una forma de radiación electromagnética‒. La teoría de Maxwell exigía que la velocidad de la luz fuera «absoluta»; en otras palabras, la luz siempre viajará a la misma velocidad, tanto si el observador se acerca o se aleja de la fuente emisora. Si dos personas están moviéndose una respecto a la otra, un rayo de luz tendrá la misma velocidad relativa para ambas.
Este hecho desafió la suposición de Newton (y la de todos los demás) de que el tiempo y el espacio debían ser absolutos ‒y sacudió los cimientos de la física‒. En manos de Albert Einstein, condujo a la inevitable conclusión de que, aunque la velocidad de la luz sea absoluta, las distancias y los intervalos de tiempo son «relativos». Las personas que se muevan de forma relativa respecto a los demás pueden medir los mismos intervalos de tiempo y espacio de forma diferente.
Las teorías de Einstein de la relatividad especial (1905) y de la relatividad general (1915) representan una reformulación de la mecánica para que se pudieran tener en cuenta los hallazgos del electromagnetismo de Maxwell. Los extraños efectos que predice la relatividad ‒el tiempo funcionando de forma diferente y las distancias acortándose o alargándose‒ son sólo relevantes a velocidades relativas especialmente altas o en campos gravitatorios intensos. En esas situaciones, los físicos utilizan la «mecánica relativista» en lugar de la mecánica basada en las leyes de Newton, que ahora reciben el nombre de «mecánica clásica». Por cierto, la ecuación más famosa de Einstein, E = mc2 , es un resultado directo de su teoría de la relatividad especial.
La mecánica que se puede utilizar para predecir el comportamiento de objetos a escala atómica ‒la mecánica cuántica‒ es otra versión no clásica de la mecánica. También es el resultado de desafíos planteados a la mecánica newtoniana y, una vez más, Einstein jugó un papel clave en su desarrollo.
¿Qué es un cuanto?
El origen de la mecánica cuántica se puede encontrar en un artículo científico publicado en 1900 por el físico alemán Max Planck (1858-1947). Planck intentaba entender la luz (y otras radiaciones electromagnéticas) que los objetos calientes radian, como el resplandor naranja de las brasas, la luz blanca emitida por la superficie del Sol y la radiación infrarroja (invisible) emitida por todos los objetos a temperatura ambiente. James Clerk Maxwell había demostrado que la luz es una onda electromagnética, una ondulación del campo electromagnético. Todas las ondas electromagnéticas son iguales excepto por su frecuencia (el número de ciclos completos que efectúa la ondulación cada segundo) y, por lo tanto, también su longitud de onda (la distancia entre picos sucesivos).
Los científicos también conocían que cuanto más caliente esté un objeto, más energía emitirá como onda electromagnética en general‒y mayor será la proporción de ondas de alta frecuencia (ondas con una longitud de onda más corta)‒. Por lo tanto, si calientas una barra de hierro hasta alcanzar una temperatura de unos 1.100 ºF (600 ºC) emitirá radiación infrarroja y algo de luz de la zona roja inferior del espectro, pero prácticamente ninguna luz de la zona azul de alta frecuencia. Si la seguimos calentando empezará a producir ondas con esas frecuencias altas ‒y a una temperatura suficientemente alta tendrá un brillo blanco cuando sus emanaciones cubran el espectro completo‒. Planck estaba tratando de desarrollar una ecuación que pudiera predecir la intensidad de cualquier frecuencia a cualquier temperatura.
De acuerdo con la teoría de Maxwell, la radiación electromagnética se produce por la vibración o la oscilación de los objetos cargados eléctricamente. Planck no sugirió cuáles eran los objetos que vibraban, pero sí que se percató de que, incluso en términos de mecánica clásica, la energía de esos «osciladores» estaba relacionada directamente con la frecuencia en la que vibraban. Planck no pudo conseguir que su ecuación fuera un reflejo de la realidad. En lo que llamó «un acto de desesperación», propuso que un oscilador no tiene «permitido» emitir cualquier cantidad de energía; en cambio, sólo puede emitir energía en unas cantidades diminutas y discretas a las que llamó «elementos de energía».

Planck también propuso un número, la constante de Planck, h. La menor cantidad de energía que un oscilador particular puede emitir es h multiplicada por la frecuencia de la oscilación, f. En otras palabras, E = hf. El oscilador puede emitir cualquier número de elementos de energía completos, pero no puede emitir fracciones de un elemento de energía. Es como poder gastar una cantidad de dólares, pero no centavos o fracciones de centavos. Si estás comprando algo que cuesta millones de dólares, no te das cuenta de esa restricción. De forma parecida, los elementos de energía de Planck pasan a ser insignificantes a la escala cotidiana, porque h es un número muy pequeño. La idea de Planck representa una clase de atomismo de la energía.
Para Planck, sólo se trataba de una conveniencia matemática, pero en manos de Einstein se convirtió en el inicio de una revolución en física. En 1905, Einstein tomó prestadas las ideas de Planck para explicar un fenómeno conocido como efecto fotoeléctrico, en el que la luz separa los electrones de sus átomos. Einstein se dio cuenta de que la energía de la luz es transportada en cantidades discretas ‒paquetes de energía, incluso partículas, a las que llamó «fotones»‒. Einstein utilizó la ecuación de Planck, E = hf, para calcular la energía de cada fotón individual de luz. Cada fotón es el equivalente a un elemento de energía o cuanto. Dado que la luz violeta tiene aproximadamente el doble de frecuencia que la luz roja, cada fotón de luz violeta tiene más o menos el doble de energía que un fotón de luz roja. La energía lumínica puede transportarse en fotones, pero no en medios fotones. Una vez más, esta restricción no significa nada en nuestros escenarios cotidianos. Si enfocas con una linterna o enciendes una vela, se emiten innumerables billones de fotones, con todo un rango de energías individuales.
El primer modelo del átomo que tenía en cuenta la cuantización fue publicado en 1913 por Niels Bohr. Se sabía desde hacía tiempo que cuando «excitas» un átomo, calentándolo o irradiándolo con luz ultravioleta, el átomo emite radiación electromagnética con unas frecuencias precisas. Así es como funcionan los pigmentos y pinturas fluorescentes ‒y por qué producen colores tan vívidos y uniformes‒. Además, dado que las frecuencias exactas de la radiación son características de los elementos presentes, la fluorescencia dota a los químicos de una forma para identificar elementos, utilizando la espectroscopia.
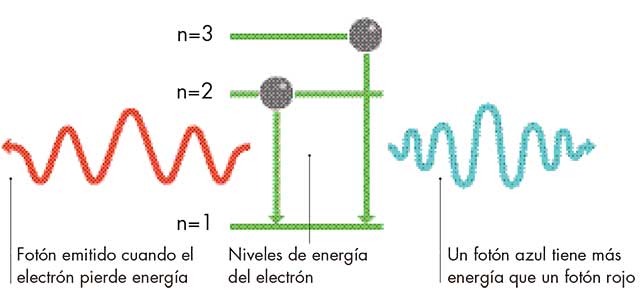

Bohr se dio cuenta de que, dado que la luz tiene frecuencias concretas, los fotones que se emiten deben tener energías definidas. Y, dado que son los electrones los que producen los fotones, su conclusión fue que los electrones deben de saltar entre niveles de energía definidos dentro del átomo. Si no fuera así, los fotones tendrían un rango continuo de energías, y la luz tendría un rango continuo de frecuencias. Bohr reconoció que el sistema completo, incluyendo las energías de los electrones en un átomo, debía de estar cuantizado. Tenía razón y hoy en día los físicos asignan un número a cada nivel de energía al que denominan «número cuántico principal» o n. Los electrones con la menor energía, n=1, se dice que están en su estado fundamental.
Bohr utilizó su teoría para calcular los niveles energéticos del electrón del átomo más simple, el hidrógeno. A continuación, calculó las frecuencias de la luz que se emitiría cuando un electrón saltara de nivel pasando de un nivel de más energía a otro de menor energía. Los resultados encajaban a la perfección con las frecuencias de la luz emitida por el hidrógeno en el mundo real. Estaba claro que los electrones del átomo no podían tener cualquier valor y que no podían ganar o perder energía continuamente. En cambio, lo hacían mediante «saltos cuánticos» repentinos y diminutos, de un valor a otro. La cuantización es un hecho presente en la vida, aunque uno sólo es significativo a escalas especialmente pequeñas.
Dualidad onda-partícula
La cuantización de la energía es uno de los pilares de la mecánica cuántica. Otro es la dualidad onda-partícula, la idea de que las entidades sujetas a las leyes de la mecánica cuántica se comportan tanto como partículas como ondas. Einstein se percató de que la luz se comporta como una corriente de partículas (fotones). Sin embargo, también está claro a partir del trabajo de Maxwell sobre el electromagnetismo (y de toda una serie de experimentos prácticos) que la luz también se comporta como una onda. Esta dualidad supone un serio desafío para el sentido común y para la experiencia cotidiana: las ondas son dispersas y continuas, mientras que las partículas son locales y discretas. Hasta el día de hoy, nadie llega a comprender cómo puede algo ser las dos cosas.
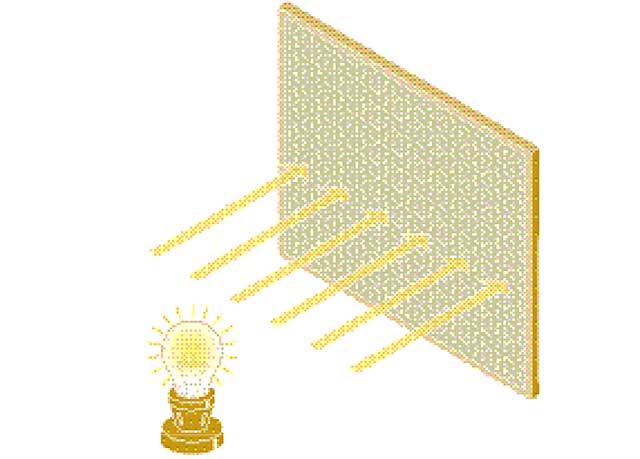
Para apreciar cómo la dualidad onda-partícula supone todo un reto para nuestra experiencia del mundo, piense en el siguiente escenario. Una fuente de luz ilumina una pantalla, la cual se cubre con una serie de detectores. Primero, consideremos que la luz es una onda. Es una perturbación en el campo electromagnético, una perturbación que se difunde a partir de la fuente. Cuando más se aleja la onda de la fuente, la energía se expande más, por lo que cada detector percibe una pequeña proporción de la energía de la luz. Todos los detectores reciben la misma cantidad al mismo tiempo.
Ahora consideremos que la luz es transportada en paquetes discretos: fotones. Cada fotón es una partícula y viaja en línea recta desde la fuente emisora hasta uno de los detectores. Si emites un fotón cada vez (existen las «fuentes de luz que emiten un único fotón»), entonces, uno y sólo uno de los detectores se activa. Ese único detector recibe toda la energía del fotón: la energía no se dispersa como antes. Cada detector tiene la misma probabilidad de recibir el fotón, por lo que, cuando se emiten grandes cantidades de fotones individuales, con el tiempo, todos los detectores reciben su parte equitativa del total de energía emitido por la fuente de luz. En otras palabras, el proceso está determinado por la probabilidad, como lanzar una moneda al aire. Cuando tiras una moneda al aire muchas veces, cada suceso es independiente de los demás, aunque, con una serie larga de lanzamientos, exactamente la mitad caerán de un lado y la otra mitad del otro. Que las monedas hagan esto ya es bastante extraño, pero que los fotones individuales puedan estar «guiados» por la probabilidad de esta manera sigue siendo un profundo misterio.
Este escenario se vuelve más extraño cuando tenemos en cuenta un enigma cuántico clásico: «el experimento de la doble rendija». Sus extrañas implicaciones son clave para la mecánica cuántica y, por lo tanto, para la comprensión de los átomos. Como sugiere su nombre, en el experimento de la doble rendija se proyecta una luz a través de dos rendijas estrechas. La luz llega a una pantalla cubierta con detectores, como en el caso de antes. Cuando una onda de luz pasa por una rendija, se dispersa, como haría cualquier onda al pasar por una abertura pequeña (el resultado de un fenómeno llamado difracción). A continuación, la rendija se comporta como una fuente de luz cuyas ondas se radian hacia el exterior hasta alcanzar la pantalla. Con dos ranuras hay, efectivamente, dos fuentes de luz cercanas, cada una de ellas emitiendo hacia la pantalla. Las dos fuentes de luz son idénticas y las ondas están sincronizadas.
Cuando la luz alcance la pantalla, habrá lugares a los que los picos y valles de las ondas de luz llegarán juntos ‒cuando las dos ondas de luz están «en la misma fase»‒. En esas posiciones, las ondas se refuerzan entre sí, creando un área de luz que es mucho más brillante de lo que hubiera sido sin las rendijas. De forma parecida, habrá lugares en los que llegará siempre un pico junto a un valle, es decir, cuando las dos ondas están «fuera de fase o desfasadas». En este caso, las dos fuentes de luz se cancelan literalmente entre sí. El resultado, pues, es una serie de franjas brillantes y oscuras en la pantalla. Esto recibe el nombre de patrón de interferencia, porque las dos fuentes de luz se están «interfiriendo» entre sí. Algunos detectores no registran luz, mientras que otros reciben luz brillante todo el tiempo.
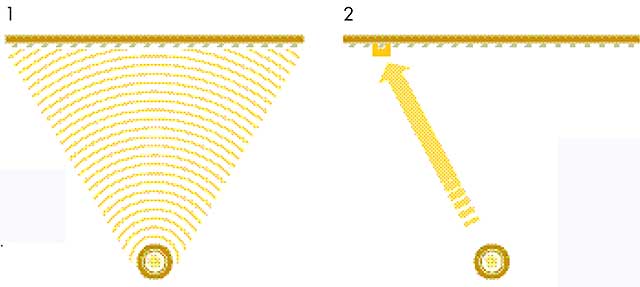
(2) Cada fotón comunica toda su energía a un único punto de la pantalla –pero tiene la misma probabilidad de impactar en cualquier sitio.
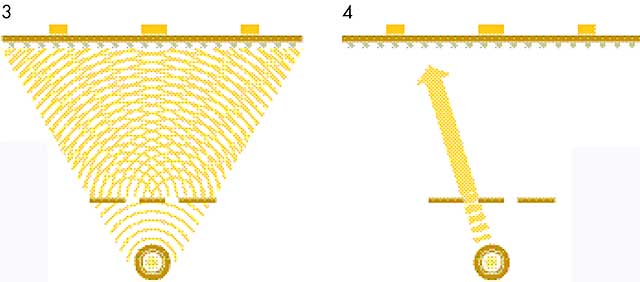
(4) El patrón de interferencia sigue apareciendo formado por muchos fotones individuales que de alguna manera interfieren entre ellos.
Este experimento se conoce desde 1800 (aunque sin la utilización de detectores en esa época) y fue una de las primeras pruebas a favor de la idea de que la luz era un movimiento ondulatorio. El escenario se vuelve más desafiante cuando repites el experimento utilizando un fotón cada vez, usando, como antes, una fuente de luz que emite fotón a fotón. En ese caso, sólo un detector recibirá cada fotón, y ese fue el caso con las rendijas. Pero, ahora, cuando los fotones pasan de uno en uno desde la fuente hasta la pantalla, pasando por las rendijas, algunos detectores nunca reciben un fotón. Curiosamente, con el paso del tiempo, las respuestas acumuladas de los detectores producen el mismo patrón general de interferencias, como puedes ver cuando iluminas con una luz brillante. Las conclusiones inevitables parecen ser que cada fotón viaja de alguna manera a través de ambas rendijas e «interfiere consigo mismo» y que los fotones se están comportando realmente como ondas y como partículas al mismo tiempo.
La dualidad onda-partícula funciona en ambos sentidos. No sólo la luz, considerada tradicionalmente como una onda, se comporta como una corriente de partículas, sino que los electrones, considerados tradicionalmente como partículas, se comportan como ondas ‒como hace cualquier partícula a escala atómica‒. Si realizamos el experimento de la doble ranura con electrones en lugar de con luz, obtendremos los mismos resultados. Ya sea con fotones o con electrones, la naturaleza ondulatoria de estas partículas se manifiesta como una probabilidad de que se puedan encontrar en posiciones concretas. La probabilidad se determina con el diseño experimental (en este caso, la distribución de las dos rendijas).
El texto y las imágenes de esta entrada son un fragmento de: “El átomo. Componente fundamental de todas las cosas”

Un cordial saludo. Con respecto a la Constante de Planck, y asumiendo que puede ser un tema “interesante” a colegiar, quiero compartir la siguiente “observación”:
Si tenemos en cuenta que:
1ro- En los eventos de comportamiento Oscilatorio está conceptualizado claramente que la “frecuencia” es la cantidad de Oscilaciones que ejecuta la onda en un intervalo de tiempo determinado (por ejemplo, “20 Oscilaciones/segundo”) aunque por motivos prácticos en las ecuaciones aparezca anotada generalmente en la unidad “1/segundo”, lo cual tiene su origen en que el “periodo” se expresa también habitualmente en “segundos” (PERO, su unidad de medida conceptualmente rigurosa es “tiempo/Oscilación”)
2do- En base a lo anterior si ahora se procediera a anotar la “frecuencia” en su unidad “académicamente rigurosa” para enunciar la Ecuación Cuántica de la Energía de un fotón ( E = h x f ), entonces para que la unidad de medida de la Energía (E) quede en su unidad (por ejemplo, “Joules”) la unidad de medida de la Constante de Planck tendría que ser “(Joules x segundo)/OSCILACIÓN” (?!)